【转载】【科研新进展】(117)姜雨教授团队揭示反刍动物瘤胃功能创新的多种遗传进化机制
我校动物科技学院反刍动物遗传与进化研究中心在反刍动物瘤胃进化研究领域取得了新进展,并以“Modes of genetic adaptations underlying functional innovations in the rumen”为题,于11月5日《Science China-Life Sciences》杂志在线发表。该论文第一署名单位为西北农林科技大学,动科学院博士研究生潘香羽、蔡钰东、博士后李宗军、硕士研究生王妮妮、西北工业大学生态环境学院博士后陈贤情、丹麦哥本哈根大学Rasmus Heller助理教授为共同第一作者。我校姜雨教授和西北工业大学生态环境学院王文教授为共同通讯作者。
反刍动物因其独特的前胃发酵系统和反刍行为而得名,其瘤胃是前胃发酵系统的主要器官。它与微生物的紧密协作,使得反刍动物具有了高效消化植物纤维的能力并因此获得了独特的进化优势,促进了反刍动物类群的繁盛和多样性。
反刍动物并不是唯一拥有多胃室的类群,与其分歧时间约6500万年的鲸偶蹄目中,包括胼足亚目的骆驼和鲸河马亚目中的河马、鲸豚等均拥有多胃室。但由于他们食性和生态位的不同,他们的胃室特化出各自不同的特征。瘤胃作为反刍动物进化过程中的重要器官,为系统解析其功能创新背后的遗传进化模式,研究人员联合国内外10多家单位收集了反刍动物类群所在的鲸偶蹄目的50种组织共897个转录组数据,覆盖了其中三个拥有多胃室结构的亚目(反刍亚目、胼足亚目和鲸河马亚目)。利用比较基因组学和比较转录组学方法对反刍动物瘤胃的功能创新的遗传进化基础进行了探究,并进一步对候选基因的功能进行了验证。
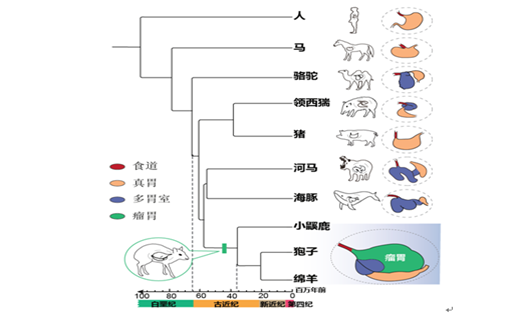
偶蹄目多胃室物种的系统发育树
该研究利用首次开发的组织特异表达基因筛选指标E50,鉴定到655个瘤胃相对其他组织高表达的基因。其中14.7%的基因来自食道组织,其余的大部分募集自表皮、免疫和消化代谢等相关组织,这些基因参与的功能通路都与瘤胃已知的功能高度相关。通过比较骆驼、鲸豚和反刍动物的第一胃室的表达谱,研究结果发现瘤胃与鲸偶蹄目其他物种的第一胃室可能共享来自食道的发育起源,瘤胃不仅上调了食道表达的基因,还从其他组织募集了更多基因的表达,从而进化出不同的表皮结构、增强的酮体代谢和特异调控微生物群落结构的能力。
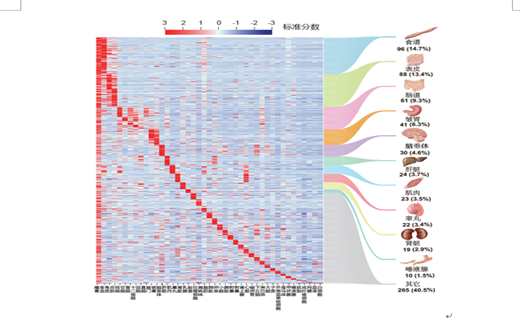 瘤胃基因的募集来源
瘤胃基因的募集来源
更重要的是,结合反刍动物比较基因组学分析,该研究发现大多数的(77.65%)瘤胃核心基因附近富集了反刍动物特异的非编码保守序列,并部分地被瘤胃和食道的开放染色质区域验证,证实调控改变是器官进化遗传机制最活跃的方式。此外,在酮体代谢通路关键限速酶基因HMGCS2中发生了5个反刍动物特异的氨基酸突变,酶活性试验结果表明这些突变使得该蛋白与其他哺乳动物相比拥有更高的利用乙酰辅酶A合成羟甲基戊二酰辅酶A的酶活性,可能赋予了反刍动物更高效的能量代谢效率。抑菌圈试验发现反刍动物新产生的基因(DEFB1和LYZ1)能够选择性地抑制革兰氏阳性菌,这一结果表明通过新基因的产生,瘤胃可能具有了特异调控微生物群落的功能。
该研究揭示了瘤胃功能创新的遗传进化基础,鉴定到的瘤胃核心基因及其特异突变为今后研究瘤胃的发育基因调控网络,以及瘤胃与微生物群之间的相互作用提供了一个起点。同时,该研究也为进一步优化提高反刍家畜生产性能提供了新的思路。开发出的E50方法为复杂器官的特异表达基因的研究提供崭新的途径,有望被广泛使用。
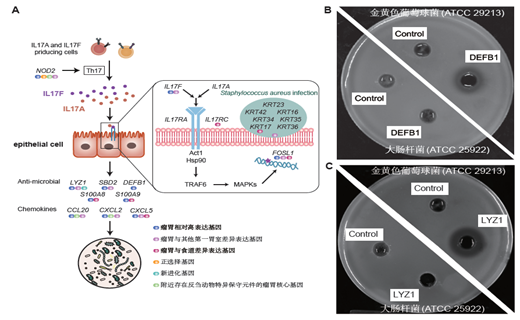 瘤胃调控微生物。A.瘤胃关键基因在IL17信号通路和金黄色葡萄球菌感染通路中涉及的多种遗传机制,B.瘤胃新基因DEFB1和C. 新基因LYZ1对金黄色葡萄球菌有抑菌活性。
瘤胃调控微生物。A.瘤胃关键基因在IL17信号通路和金黄色葡萄球菌感染通路中涉及的多种遗传机制,B.瘤胃新基因DEFB1和C. 新基因LYZ1对金黄色葡萄球菌有抑菌活性。
该研究得到国家有关项目及学校高性能计算平台的支持。
原文链接:http://engine.scichina.com/doi/10.1007/s11427-020-1828-8